
Novità e trend
Lo spaventagatti e altri gadget dal futuro
di Aurel Stevens

«Con questa batteria, il telefono dura una settimana»; «Questa nuova batteria carica il telefono in 15 minuti!»... Suona familiare? Ogni mese si sente parlare di una nuova batteria miracolosa che di lì a poco sarà disponibile sul mercato. D'accordo, è arrivato il momento di fare un reality-check.
All'inizio del 2016, Philipp Rüegg e io abbiamo lanciato la modesta redazione di digitec e Galaxus. Una delle mie prime storie è stata quella del Mobile World Congress (MWC) che si è tenuto a Barcellona. Oggi in redazione siamo in 15 e Dominik Bärlocher è responsabile di tutto ciò che abbia a che fare con gli smartphone. E lo fa molto meglio di me. Ma non è questo il punto. In quell'occasione, MyFC aveva introdotto il JAQ: una cella a combustibile intercambiabile che carica gli smartphone senza presa di corrente grazie a comode cartucce. Fenomenale!
Eppure, due anni dopo, che ne è stato del JAQ? Molti comunicati stampa (in inglese) ne millantano le proprietà, ma purtroppo la batteria ancora non si trova in commercio nei negozi. Un po' come il Notebook NEC dotato di cella a combustibile, che era già stato presentato come prototipo 15 anni fa.
Le celle a combustibile quindi sono obsolete? Naturalmente no. Anzi, Toyota attualmente punta molto su questa tecnologia. Non è ancora un successo clamoroso, ma ci stanno lavorando. Le celle a combustibile continuano a essere un accumulatore di energia portatile molto promettente.
L'industria automobilistica è un terreno fertile. Tesla e altre aziende del settore continuano ad aumentare la già enorme necessità di accumulatori energetici e soprattutto batterie sempre più efficienti. Così come il fotovoltaico, una tecnologia che viene utilizzata sempre di più ed è disponibile a prezzi sempre più convenienti. Il mondo aspetta la prossima generazione di batterie con il fiato sospeso. Anche tu, vero?
Oggi daremo uno sguardo alla teoria di come funziona una batteria, così avrai qualche nozione su cui basarti la prossima volta che sentirai parlare di batterie magiche o miracolose che, in fondo alla pagina e in carattere microscopico, riportano: «disponibile sul mercato tra qualche anno». Infatti non è raro che versioni intermedie di questi modelli e altri materiali «magici» vengano presentati al mondo come «The Next Big Thing» – una vera e propria rivoluzione.
Giusto per fare un esempio...

Fonte:Computerbild
..e la dicitura in piccolo proprio alla fine dell'articolo :
Non sappiamo ancora quando le batterie al grafene saranno prodotte su larga scala e trasformate in un prodotto finale.
In generale, la stampa preferisce dipingere un quadro eccessivamente ottimistico dei risultati della ricerca, perché così le testate possono scriverci dei bei titoli. In realtà, la maggior parte dei concetti viene scartata. Ovviamente questi fallimenti non fanno notizia, anche se sono importanti tanto quanto i successi. Infatti, tutta questa ricerca non viene fatta invano: dopo tutto, è importante capire anche cosa non funziona.
A proposito di ricerca: sviluppare una batteria è un processo molto lungo e laborioso. Ci vogliono almeno dieci anni prima che una batteria passi dal laboratorio al negozio online. Creare una catena di produzione efficiente in sé richiede diversi anni. I produttori dei dispositivi devono adattare i loro prodotti, caricabatterie e processi. Le autorità richiedono controlli di sicurezza dettagliati, e così via. Bosch, il più grande produttore mondiale di dispositivi, alla fine del febbraio 2018 ha deciso di abbandonare la produzione delle proprie celle (in tedesco) perché troppo costose.
Ovviamente, le nuove batterie devono essere migliori delle precedenti, altrimenti dove sarebbe l'incentivo e che senso avrebbe continuare a far ricerca? Idealmente, dovrebbero soddisfare al meglio una serie di requisiti per ogni scopo previsto:
..basta così? La batteria perfetta deve essere in grado di fare parecchie cose, eh?
A seconda dell'uso previsto, le batterie possono anche avere altre caratteristiche. Al momento, le batterie per auto usano piombo e acido solforico perché sono materiali economici e il fatto che siano piuttosto pesanti non è di grande importanza. La stessa cosa vale per le batterie utilizzate in casa, che servono a immagazzinare energia solare: a nessuno importa che siano ingombranti o meno perché vengono comunque collocate in cantina, perciò costano meno. I dispositivi mobili, tuttavia, richiedono batterie molto compatte e leggere.
E ora viene la parte difficile: ottimizzare una caratteristica quasi sempre avviene a discapito di un'altra. L'esempio di Samsung lo dimostra bene: la batteria con grafene si carica molto rapidamente e ha una capacità molto elevata grazie a questo nuovo materiale straordinario, ma così vengono sacrificate le dimensioni: le sfere di grafene hanno una densità volumetrica molto superiore a quella della grafite convenzionale. (l'articolo che trovi a questo link è stato scritto da uno dei ricercatori di Samsung).
Per evitare di farci ingannare dai titoli dei giornali, dobbiamo capire a che punto è realmente la ricerca. E per fare ciò dobbiamo capire come funziona una batteria. Ecco perché oggi studiamo un po' di teoria e facciamo una breve incursione nell'universo dell'elettrochimica. L'idea ti fa sudare freddo? Tranquillo. L'argomento è decisamente complicato, ma qui parleremo solo dell'essenziale.
Il principio del funzionamento di qualsiasi cella o batteria è molto semplice: quando colleghi un oggetto che consuma energia (una lampadina, ad esempio) a una batteria, l'energia chimica immagazzinata viene trasformata in energia elettrica. A differenza dei modelli usa e getta, le batterie ricaricabili possono anche seguire il processo inverso, immagazzinando l'energia elettrica come energia chimica.
Vengono utilizzati diversi metodi e materiali, ma i componenti sono sempre gli stessi: due elettrodi, un elettrolita e un separatore. Quando un oggetto che consuma energia è collegato a una batteria, chiude il circuito elettrico e provoca una reazione chimica che permette agli elettroni di fluire.
Gli elettrodi (poli) sono costituiti da materiali diversi. Uno ha un legame più debole con gli elettroni e rilascia ioni. L'altro assorbe gli elettroni e incorpora gli ioni liberi in una nuova molecola.
Un elettrodo è chiamato anodo, l'altro catodo. Durante la scarica, l'anodo è il polo negativo, mentre il catodo è il polo positivo. Durante la carica, i poli si invertono. I termini «anodo» e «catodo» sono quindi più precisi di «polo positivo» e «polo negativo». L'anodo richiede una reazione chimica che emette elettroni. Durante il processo, vengono rilasciati gli atomi a carica positiva – i famosi ioni! – che però voglio assolutamente tornare in uno stato neutro. Viaggiano negli elettroliti. Il catodo assorbe molto bene gli elettroni e reagisce in un'altra molecola. Gli ioni vengono attratti dal separatore e reintegrati.
La differenza che questo processo crea dopo la reazione in un'altra molecola è chiamata «potenziale redox» (o «potenziale di riduzione») e viene misurata in volt. Il potenziale di molecole idonee è indicato in serie elettrochimiche. Se dai uno sguardo alla tabella (in tedesco), capirai perché il litio è così interessante.
La batteria contiene due coppie di reazioni compatibili tra loro: gli elettroni scorrono dall'anodo al catodo e le reazioni da entrambi i lati devono interagire con gli stessi ioni. L'anodo emette elettroni e rilascia ioni. Questo processo chimico si chiama ossidazione. Il catodo accetta gli elettroni e lega gli ioni in un processo noto come riduzione. In chimica, questi due processi insieme vengono chiamati reazioni di ossidoriduzione (o reazioni redox). Ci sono quindi due (!) coppie di reazioni chimiche che interagiscono come un sistema complessivo: le coppie redox.
Le reazioni chimiche avvengono nella cellula finché entrambi gli elettrodi hanno molecole che liberano elettroni o vogliono assorbirli. Non appena uno degli elettrodi non offre molecole in grado di rilasciare o assorbire e legare elettroni e ioni, il processo si arresta. In altre parole: la batteria si scarica. La cosa fantastica è che la batteria inverte la reazione chimica quando viene riceve elettroni.
Se l'elettricità fosse come l'acqua, la tensione sarebbe la differenza tra i due poli: un punto è molto alto, l'altro molto basso. Pertanto, gli elettroni vogliono «fluire verso il basso», verso l’altro polo. L’intensità della corrente, invece, si determina in base a quanti elettroni scorrono effettivamente e si misura in ampere. Usiamo di nuovo l’analogia con l’acqua: quando ti trovi davanti a un corso d’acqua, è chiaro che si tratta di un ruscello o di un torrente in base alla pressione dell’acqua, a quanto è ripido il pendio (volt) e quanta acqua scorre (ampere). Ciò che risulta da volt × ampere è la potenza in watt. Potenza × unità di tempo (mAh, Wh) = energia.
Questa correlazione è importante. Nel tuo telefono cellulare o notebook, ad esempio, la capacità di solito viene indicata in milliampere/ora (mAh). Considerando la formula di cui sopra, ora sai che mAh non significa molto se non conosci anche la tensione della cella. Esempio: se hai una batteria al nichel-cadmio da 1'000 mAh e una batteria agli ioni di litio da 500 mAh, quale delle due ha più capacità? La batteria NiCd ha una tensione nominale di 1,2 volt. La batteria agli ioni di litio, invece, di 3,6 volt. Per analogia con la formula di cui sopra: wattora = volt x mAh. Il tutto diviso per 1’000, perché stiamo parlando di miliardi di ore. Quindi: la batteria NiCd immagazzina 1,2 wattore di energie, mentre la batteria agli ioni di litio 1,8 wattore!
La tensione varia a seconda del livello di carica: è molto più alta quando la batteria è completamente carica rispetto a quando è quasi scarica. La tensione delle batterie per auto varia da 1,75 volt a 2,4 volt a seconda del livello di carica. La tensione desiderata influisce sulla costruzione della batteria. Se hai un’auto, probabilmente sai che una batteria per auto non ha 2 volt, bensì 12, perché è costituita da 6 celle assemblate in serie. La tensione è di 12 volt. O più precisamente di un valore compreso tra circa 10,5 V e 14,4 V. La tensione cellulare è solo uno dei tanti modi per determinare lo stato di carica.

Una batteria al piombo tagliata a metà: le 6 celle arrivano fino a una tensione totale di circa 12 volt. Immagine: Wikipedia/Ben Cossalter
Le celle possono anche essere collegate in parallelo per aumentare la capacità della batteria. L’immagine qui sopra lo illustra bene: ogni cella è fatta di un «sandwich» di piastre di piombo e di ossido di piombo.
Come avrai intuito dall’immagine della vecchissima batteria al piombo qui sopra, in cui si sono formati cristalli di PbSO₄ sempre più grandi sugli elettrodi un tempo immacolati, riducendo notevolmente la superficie elettrochimica attiva e diminuendone la capacità, i cicli di carica e scarica non possono essere ripetuti all’infinito.
Fenomeni molto simili si verificano nelle batterie agli ioni di litio, che le danneggiano nel tempo. Durante la carica sull’anodo si forma una pellicola che copre la superficie della grafite, impedendole di interagire con l'elettrolito e gli ioni; la capacità diminuisce. Analogamente, il catodo sulle batterie agli ioni di litio è soggetto a un effetto noto come ossidazione elettrolitica. Ciò tende a verificarsi quando c’è un’alta tensione cellulare, ovvero quando la cella è completamente carica. Le batterie agli ioni di litio si considerano consumate quando rimane solo l'80% della loro capacità originale. A questo punto, la batteria invecchia sempre più rapidamente.
In sintesi, molte reazioni chimiche non avvengono completamente. Soprattutto quando la batteria è del tutto scarica o carica, questi effetti si intensificano in molti tipi di batterie. Anche temperature molto basse o molto alte e una carica o una scarica troppo rapide accelerano questi processi indesiderati. L’efficacia della reazione chimica è nota come efficienza di Coulomb o di Faraday (in inglese).
In laboratorio si cerca di ridurre al minimo questi effetti collaterali utilizzando nuovi materiali o additivi aggiunti agli elettroliti. Questo è anche il motivo per cui l'anodo di molte batterie è ricoperto di grafite. Il litio non è esposto direttamente all’elettrolito e quindi si danneggia molto meno rapidamente.
Ora sai di cosa si occupa la ricerca sulle batterie. Per ricapitolare, si prefigge di...
Bene, è il momento di arrivare al succo del discorso! Su quali tecnologie si concentra la ricerca sulla batteria e cosa le rende così promettenti?
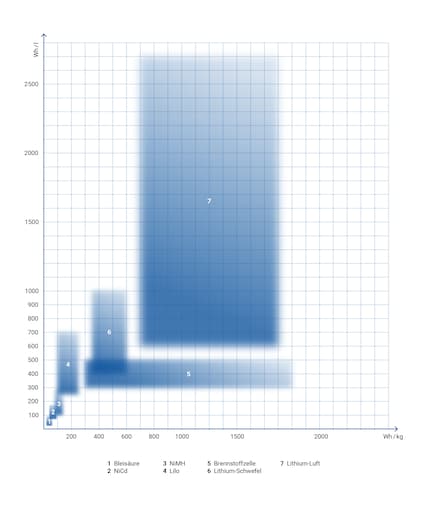
Densità energetica di varie batterie. Grafico: Sven Mathis
Il grafico è molto semplificato. La densità energetica non può essere illustrata come un rettangolo. Immagina che i punti rappresentino i vari tipi di batterie. Non esiste la batteria NiMH né la batteria agli ioni di litio, ma ce ne sono diversi modelli e versioni, che la ricerca continua a sviluppare per poterli posizionare piuttosto a destra, possibilmente in alto, nella tabella. Le tecnologie in evoluzione, come le batterie al litio e allo zolfo, si trovano in basso a sinistra, mentre l’angolo in alto a destra rappresenta le tecnologie più promettenti. Ho scelto di concentrarmi sui valori stimati nella pratica piuttosto che su quelli massimi teorici.
Il grafico mostra la storia dello sviluppo della batteria:
Se confrontassimo la densità energetica di queste batterie con quella della benzina e del gasolio, il grafico sarebbe molto diverso: tutte le batterie sarebbero rappresentate in basso a sinistra. La benzina trionfa con 13'000 Wh al litro. Spostiamoci un pixel più a sinistra: la densità energetica della fissione nucleare, milioni di volte superiore, batte tutti gli elementi del quadro.
Batteria agli ioni di litio
La batteria agli ioni di litio è il tipo di accumulatore più utilizzato. Offre vantaggi significativi rispetto ai suoi predecessori. L’effetto memoria è quasi inesistente, rendendo superflue la carica e la scarica complete; un vantaggio inestimabile nella vita di tutti i giorni. Questo tipo di batteria è anche più piccolo, più ecologico e meno costoso. Ha un'autoscarica inferiore rispetto alle batterie NiMH, che perdono il 20% al mese.
Non esiste una singola batteria agli ioni di litio, ma piuttosto una varietà di modelli. Tutti sono caratterizzati da una buona densità energetica, da una bassa autoscarica e dal fatto che le varianti moderne possono resistere a diverse centinaia di cicli di carica. Per quanto riguarda l’utilizzo, sono più che sicure. O, almeno, finché non li schiacci, come ha fatto Samsung con il Note 7: la grafite sul catodo si gonfia quando gli ioni di litio vengono catturati. Se non c'è abbastanza spazio, la batteria esplode e il litio, estremamente reattivo, reagisce con il resto della batteria.
La batteria agli ioni di litio ha anche grandi svantaggi. Non sopporta il calore e si guasta rapidamente quando la temperatura è elevata. Non può essere caricata a temperature inferiori a 0°C e le scariche profonde la distruggono. Ecco perché, se le smonti, scopri un sistema elettronico complesso e anche un sensore di temperatura. L'elettronica contribuisce a garantire che la batteria funzioni entro parametri sicuri e non venga danneggiata. D’altra parte, induce una perdita di carica di circa il 3-5% al mese senza che tu la utilizzi.
Mi raccomando: non smontare batterie o accumulatori, è pericoloso! Dai uno sguardo alla batteria (sostituibile) di questo portatile:

I conduttori marroni corrispondono al sensore di temperatura. Qui è possibile vedere come le singole celle sono collegate in serie e in parallelo. Molte batterie per notebook sono costituite da 18650 celle. Fonte: Wikipedie/Lead holder
Ti ricordi le proprietà della batteria che ho introdotto all’inizio dell'articolo? Proprio per questo motivo le batterie agli ioni di litio sono disponibili in un'ampia gamma di versioni. Alcune sono più sicure, altre più resistenti ai cicli. Gli smartphone sono quasi sempre dotati di cobalto, per la precisione LiCoO₂ (LCO). È il primo tipo sviluppato e le sue prestazioni sono più che raddoppiate dal 1991. Giusto per fare un confronto con le altre varianti comuni:
Dati di riferimento di altre batterie agli ioni di litio. Più alte sono le barre, migliore sarà il valore. Fonti: Boston Consulting Group, batteryuniversity.com. Grafico: Sven Mathis
Batterie ai polimeri di litio
Se hai un veicolo telecomandato, probabilmente conosci le batterie ai polimeri di litio (LiPo). In realtà, dovrebbero chiamarsi «batterie agli ioni-polimeri di litio» perché, da un punto di vista elettrochimico, sono simili ai modelli presentati prima. La differenza sta nell’elettrolito: nelle batterie Li-Io convenzionali è liquido, in quelle ai polimeri è solido. I polimeri sono macromolecole filamentose allineate l’una dietro l'altra, che si trovano anche in natura (ad esempio, i tuoi capelli sono fatti di polimeri). I polimeri vengono anche prodotti artificialmente. Nelle batterie LiPo, i polimeri sono presenti sotto forma di sostanze gelatinose filamentose. Sono conduttivi e assorbono un gran numero di ioni.
L’elettrolito solido ha vantaggi pratici: grazie alla loro stabilità intrinseca, le LiPo possono essere prodotte in varie forme. È necessaria una copertura meno stabile; è sufficiente una pellicola sottile e leggera. Forse sai che le batterie RC sono particolarmente delicate. Se le danneggi o sovraccarichi, si gonfiano e prendono fuoco. Ecco perché i modellisti conservano le loro batterie ai polimeri di litio in sacchetti ignifughi. A nessuno piacciono gli incendi.
Queste batterie sono infiammabili perché sono più densamente energetiche e leggere che sicure. Per garantire la sicurezza necessaria, il caricabatterie è dotato di dispositivi elettronici appositi. In linea di principio, le batterie ai polimeri di litio possono essere prodotte con la stessa sicurezza delle batterie agli ioni di litio. Il Macbook Pro su cui scrivo questo articolo è dotato di una LiPo a sei celle.
Batterie al litio-metallo*
Il litio-metallo è considerato un successore promettente della tecnologia agli ioni di litio. Il litio-metallo attualmente viene già utilizzato, ma non per modelli ricaricabili. Ad esempio, nelle pile al litio rotonde. Le batterie al litio-metallo promettono il doppio della densità energetica delle batterie agli ioni di litio e un'autoscarica bassa perché, in assenza di uno strato di grafite, il litio è direttamente esposto all’elettrolito. La superficie chimicamente attiva è quindi molto ampia, il che aumenta la capacità e riduce il tempo di ricarica. Queste batterie sono anche più compatte in quanto non contengono grafite.
Le batterie ricaricabili al litio-metallo non sono pronte per essere introdotte sul mercato. Infatti, i metalli direttamente esposti formano i cosiddetti dendriti a ogni nuovo ciclo. Si tratta di depositi che formano una stalagmite nell'elettrolita e possono anche forare il separatore, causando un cortocircuito. I ricercatori non sono ancora riusciti a evitare o a rallentarne la formazione in misura adeguata.
Batterie a stato solito
Attualmente si parla molto delle batterie a stato solido. In realtà, sono solo un elemento utilizzato nella produzione di batterie litio-metallo. Il concetto è che l’elettrolito non è liquido, ma è costituito da un materiale poroso o cristallino che impedisce la formazione di dendrite. Può anche essere più sottile del «sandwich» di elettrolita liquido + separatore + elettrolita liquido. Consente anche di realizzare progetti molto più flessibili, ad esempio pellicole sottili. Le batterie a stato solido tendono ad avere una durata maggiore. Sono anche più sicure, perché l’elettrolito non può fuoriuscire.
Ormai hai capito come funziona: per essere così durevoli e sicure, a quali caratteristiche devono rinunciare? Ottima domanda. Risposta: alle prestazioni. Le batterie a stato solido che abbiamo visto finora conducono gli ioni con meno efficienza rispetto alle batterie liquide. Ciò significa che la carica tende a durare più a lungo e che durante la scarica possono essere assorbite meno correnti elevate. I modelli moderni sono anche meno resistenti alle basse temperature. I prototipi attuali possono resistere solo a poche centinaia di cicli e, per finire, gli elettroliti solidi di oggi sono estremamente costosi. Una batteria per auto con elettrolito solido costerebbe decine di migliaia di franchi.
Batterie al litio-zolfo
La batteria al litio-zolfo è considerata un possibile successore ad alto potenziale. I ricercatori ci stanno lavorando (e perfezionando) dagli anni ’60. La sua densità energetica è circa tre volte superiore a quella delle batterie agli ioni di litio. Litio e zolfo sono leggeri. La reazione chimica avviene anche a basse temperature: può essere caricata fino a -60°C. La batteria è ecologicamente sostenibile e lo zolfo si trova in abbondanza.
Come nelle batterie al litio-metallo, l’anodo non è ricoperto di grafite, il che lo rende più leggero e compatto. L'ossido di metallo del catodo è sostituito dallo zolfo, più economico e leggero. La reazione chimica è efficace perché due ioni di litio possono legarsi a ciascuna molecola.
La densità energetica e la potenza ottengono già valori molto elevati in laboratorio. Tuttavia, i prototipi ottimizzati fino ad ora purtroppo si guastano piuttosto rapidamente: riescono a completare solo poche decine di cicli. Negli ultimi cinque anni, i ricercatori hanno aumentato i cicli a oltre 4’000, sacrificando la potenza e la densità energetica.
Batterie al litio-aria*
La batteria al litio-aria è oggetto della ricerca sin dagli anni ’70. Un po’ il santo graal della ricerca sulle batterie, per così dire. E questo per due ragioni: in primo luogo permettono di risparmiare molto spazio, perché uno dei componenti reattivi (O₂) proviene dall’ambiente e quindi non deve essere inserito nella batteria. In secondo luogo, la batteria al litio-aria ha una densità energetica teorica di ben 13 kWh al chilo, la stessa della benzina. In pratica, dovrebbe raggiungere circa 2'800 Wh/kg. Poiché il motore a combustione ha una bassa efficienza, pari al 30%, una batteria al litio (efficiente al 90%) sarebbe rivoluzionaria in un’auto elettrica.
Se vogliamo vedere queste batterie in commercio, probabilmente dovremo essere pazienti. Molti ricercatori dubitano persino che potranno mai essere immesse sul mercato di massa a causa dei loro numerosi problemi.
Batterie agli ioni di sodio
Nelle batterie agli ioni di sodio, il litio è sostituito dal sodio. La densità energetica è piuttosto bassa e si aggira intorno ai 90 Wh/kg. Batterie di questo tipo sarebbero pertanto molto pesanti e ingombranti. Tuttavia, possono essere utilizzate in situazioni in cui peso e spazio non rappresentano un problema. Infatti, il sodio è disponibile in quantità quasi illimitata e quindi si trova molto a buon mercato e inoltre è più sicuro rispetto al litio. Un altro aspetto positivo è che la reazione chimica resiste alle scariche complete.
Ulteriori sviluppi con il grafene

Grafene. (Fonte: Wikipedia/AlexanderAlUS)
Finora, la grafite è stata utilizzata sugli elettrodi delle batterie Li-Io. Si tratta di una forma di carbonio puro, come il diamante, ma con una struttura atomica diversa. Lo stesso vale per il grafene, la cui struttura bidimensionale ricorda una struttura a nido d’ape. Il grafene: un sogno. Ha proprietà davvero sorprendenti: è 125 volte più resistente dell’acciaio, più duro del diamante, può essere arrotolato, è trasparente, impermeabile ai liquidi ed estremamente conduttivo.
Quest'ultima proprietà lo rende interessante per le batterie. La stabilità del grafene aumenta significativamente la durata dell'anodo che copre. Come materiale catodico, grazie all’ampia superficie ridurrebbe drasticamente il tempo di carica e aumenterebbe notevolmente la capacità della batteria.
In teoria, il grafene potrebbe aiutare a creare le batterie del futuro. In teoria, appunto (in tedesco). Il suo potenziale senza pari è proporzionale alle sue proprietà mirabolanti. Il problema è che il grafene è difficile da produrre in forma pura e in grandi quantità. Probabilmente ci vorranno altri dieci anni prima che potrà essere utilizzato nelle batterie.
Celle a combustibile
Le celle a combustibile sono disponibili in un'ampia gamma di versioni. Lavorano con composti alcolici, soluzioni di glucosio o idrogeno compresso. A differenza di un motore a combustione, questi elementi convertono l'energia chimica direttamente in energia elettrica utilizzando un agente ossidante. In questo senso, il termine «cella a combustibile» è un po’ fuorviante.
La cella a combustibile a idrogeno/ossigeno è la variante più comune. Ha il vantaggio di poter estrarre dall'ambiente uno dei componenti reattivi essenziali, l'agente ossidante (ossigeno). Il prodotto della reazione chimica è l’H₂O. Il «gas di scarico» quindi è l’acqua, cosa che non può essere altro che positiva per l’ambiente. A livello locale, le celle a combustibile potrebbero avere un effetto di pulizia miracoloso e risolvere completamente i problemi dei gas di scarico nelle città.
A livello globale, tuttavia, la sua produzione non è ecologicamente sostenibile: l’intero processo di produzione, dalla fabbricazione dell’ossidrogeno o del metanolo alla trasformazione in energia elettrica, è tutto meno che efficiente. L'efficienza dell'intera catena, dalla produzione alla lavorazione, è di circa il 60%. Nelle regioni in cui le energie rinnovabili sono abbondanti, questo svantaggio ha meno peso.
La cella a combustibile attualmente si trova in commercio. Il prossimo passo è quello di miniaturizzarla, ma per ora non ci sono le infrastrutture necessarie. E più vengono sviluppate le nuove tecnologie, più l’inefficienza della cella a combustibile la fa sembrare meno allettante.
Ops. L’articolo è venuto un po’ più lungo del previsto. Bene, almeno ora sai come funziona una batteria e quali miglioramenti puoi aspettarti in questo settore. Si tratta di un argomento interessante e alcune delle tecnologia di cui abbiamo parlato sembrano abbastanza promettenti. Chissà, forse una nuova start-up cambierà completamente il settore delle batterie. La cosa più importante è che ora hai le conoscenze di base per poter valutare le novità in questo mondo. Se vuoi approfondire ulteriormente il discorso, fai un giro batteryuniversity.com.
Sono il guru del team dei redattori. Scribacchino 5 giorni su 7 e papà 24 ore su 24. Mi interesso di tecnologia, computer e HiFi. Mi sposto sempre in bicicletta, in qualsiasi condizione meteo e, solitamente, sono di buon umore.
Curiosità dal mondo dei prodotti, uno sguardo dietro le quinte dei produttori e ritratti di persone interessanti.
Visualizza tutti